Un niveau d’organisation : les éléments chimiques
Lors du Big Bang, les protons, neutrons et électrons (des particules élémentaires) sont apparues. Le premier élément chimique à s’être formé est l’hydrogène. C’est ensuite au cours de réactions nucléaires, au sein des étoiles, que les autres éléments se sont créés.
La formation des éléments :
Nucléosynthèse stellaire :
Suite à des fusions nucléaires au sein des étoiles entre des noyaux d’hydrogène, des noyaux d’hélium sont générés. Les atomes d’hélium fusionnent alors à leur tour pour former des atomes plus lourds (carbone, oxygène, fer, béryllium). Quand une étoile explose, tous les éléments créés se dispersent dans l’Univers.
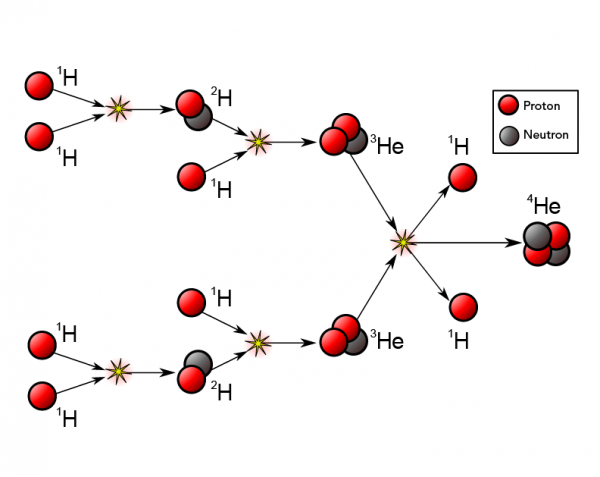
➝ Fusion : l’union de deux noyaux légers pour former un noyau plus lourd. Lors d’une fusion, une grande quantité d’énergie est libérée.
Au cours d’une fission nucléaire :
La fission nucléaire, une autre transformation, peut se produire en dehors des étoiles.
➝ Fission : un noyaux lourd qui se sépare en deux noyaux plus légers.
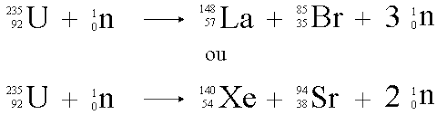
Radioactivité :
Isotopes et vallée de stabilité :
Dépendamment du nombre de protons et par rapport au nombre de neutrons, certains atomes peuvent être instables. Leur noyau se transforme en d’autres noyaux de manière spontanée. Il y a alors une désintégration avec émission de rayonnements (particules chargées et/ou ondes électromagnétiques).
➝ Radioactivité : désintégration spontanée d’un noyau instable (le noyau père) en un autre noyau plus stable (le noyau fils). Ce phénomène est aléatoire. On ne peut donc pas prévoir quand un atome radioactif va se désintégrer.
Demi-vie et datation :
La demi-vie (T1/2 ou t1/2) est la durée au bout de laquelle la moitié des noyaux d’un échantillon radioactif s’est désintégrée.
➝ Chaque noyau radioactif possède sa propre demi-vie. Donc selon le noyau radioactif, la demi-vie n’aura pas la même valeur.
Le carbone 14, produit en haute atmosphère, garde la même proportion de manière constante dans les matières vivantes. Lorsqu’un organisme meurt, la quantité de carbone 14 n’est plus renouvelée. On peut alors utiliser la demi-vie pour déterminer la proportion de carbone 14 dans l’échantillon trouvé et connaître l’époque de la mort.
